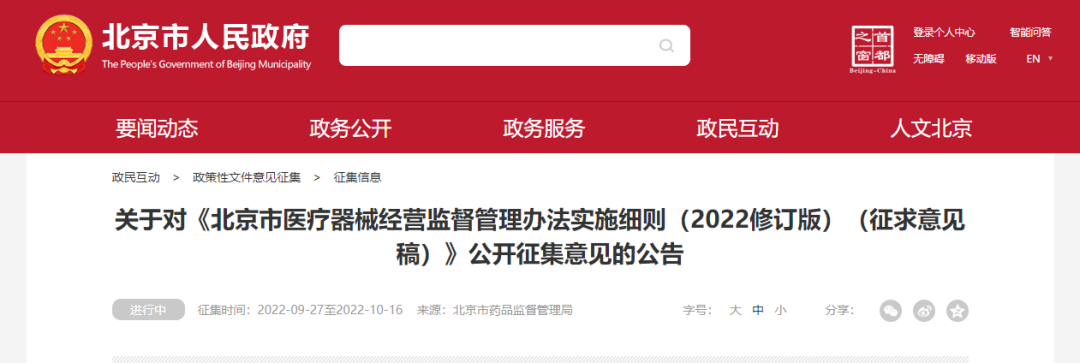
關(guān)于對(duì)《北京市醫(yī)療器械經(jīng)營(yíng)監(jiān)督管理辦法實(shí)施細(xì)則(2022修訂版)(征求意見稿)》公開征集意見的公告
為進(jìn)一步加強(qiáng)醫(yī)療器械經(jīng)營(yíng)質(zhì)量監(jiān)督管理,規(guī)范醫(yī)療器械經(jīng)營(yíng)行為�,保障公眾用械安全、有效�����,指導(dǎo)醫(yī)療器械經(jīng)營(yíng)企業(yè)采購(gòu)、驗(yàn)收��、貯存�、銷售、追溯管理等工作��,北京市藥品監(jiān)督管理局研究制定了《北京市醫(yī)療器械經(jīng)營(yíng)監(jiān)督管理辦法實(shí)施細(xì)則(2022修訂版)(征求意見稿)》�����,現(xiàn)向社會(huì)公開征求意見���,歡迎社會(huì)各界提出意見建議。
公開征集意見時(shí)間為:2022年9月27日至10月16日���。
1.電子郵件:郵件主題請(qǐng)注明“醫(yī)療器械經(jīng)營(yíng)辦法實(shí)施細(xì)則反饋意見”,郵箱地址:shichangchu@yjj.beijing.gov.cn�����。
2.郵寄通信地址:北京市西城區(qū)棗林前街70號(hào)中環(huán)廣場(chǎng)A座1402室藥械流通處�����,郵政編碼:100053�。(請(qǐng)?jiān)谛欧馍献⒚鳌耙庖娬骷弊謽樱?/span>
5.登錄北京市人民政府網(wǎng)站(http://www.beijing.gov.cn)����,在“政民互動(dòng)”版塊下的“政策性文件意見征集”專欄中提出意見��。
北京市藥品監(jiān)督管理局
2022年9月27日
附件1:《北京市醫(yī)療器械經(jīng)營(yíng)監(jiān)督管理辦法實(shí)施細(xì)則(2022修訂版)(征求意見稿)》
附件2:《北京市醫(yī)療器械經(jīng)營(yíng)監(jiān)督管理辦法實(shí)施細(xì)則(2022修訂版)(征求意見稿)》的修訂說(shuō)明
附件1:
北京市醫(yī)療器械經(jīng)營(yíng)監(jiān)督管理辦法實(shí)施細(xì)則
(2022年修訂版)(征求意見稿)
第一條??為了加強(qiáng)醫(yī)療器械經(jīng)營(yíng)監(jiān)督管理����,規(guī)范我市醫(yī)療器械經(jīng)營(yíng)活動(dòng),保證醫(yī)療器械安全����、有效�,根據(jù)《醫(yī)療器械監(jiān)督管理?xiàng)l例》和《醫(yī)療器械經(jīng)營(yíng)監(jiān)督管理辦法》(以下簡(jiǎn)稱《監(jiān)督管理辦法》)�,結(jié)合監(jiān)管實(shí)際,制定本細(xì)則����。
第二條 在北京市行政區(qū)域內(nèi)從事醫(yī)療器械經(jīng)營(yíng)活動(dòng)及其監(jiān)督管理,應(yīng)當(dāng)遵守本細(xì)則�����。
第三條 根據(jù)企業(yè)類型和所經(jīng)營(yíng)醫(yī)療器械產(chǎn)品風(fēng)險(xiǎn)程度����,對(duì)第三類醫(yī)療器械經(jīng)營(yíng)企業(yè)��、第二類醫(yī)療器械經(jīng)營(yíng)企業(yè)(以下簡(jiǎn)稱醫(yī)療器械經(jīng)營(yíng)企業(yè))以及為醫(yī)療器械注冊(cè)人����、備案人和經(jīng)營(yíng)企業(yè)專門提供醫(yī)療器械運(yùn)輸�、貯存服務(wù)的企業(yè)(以下簡(jiǎn)稱提供醫(yī)療器械第三方物流服務(wù)企業(yè))實(shí)施分類分級(jí)管理并動(dòng)態(tài)調(diào)整����。
第四條 北京市藥品監(jiān)督管理局負(fù)責(zé)制定全市醫(yī)療器械經(jīng)營(yíng)企業(yè)和提供醫(yī)療器械第三方物流服務(wù)企業(yè)監(jiān)督管理政策���,指導(dǎo)�、督促區(qū)市場(chǎng)監(jiān)督管理局開展監(jiān)督管理工作���,組織實(shí)施市級(jí)飛行檢查以及對(duì)跨行政區(qū)域提供醫(yī)療器械第三方物流服務(wù)企業(yè)的現(xiàn)場(chǎng)檢查。依法設(shè)置或者指定專業(yè)技術(shù)機(jī)構(gòu)開展醫(yī)療器械檢查��、檢驗(yàn)����、監(jiān)測(cè)與評(píng)價(jià)等工作�����。負(fù)責(zé)醫(yī)療器械經(jīng)營(yíng)監(jiān)督管理信息化建設(shè)和管理工作,統(tǒng)籌推進(jìn)醫(yī)療器械經(jīng)營(yíng)監(jiān)督管理信息共享��。
區(qū)市場(chǎng)監(jiān)督管理局負(fù)責(zé)組織開展轄區(qū)醫(yī)療器械經(jīng)營(yíng)企業(yè)以及提供醫(yī)療器械第三方物流服務(wù)企業(yè)的監(jiān)督管理���,實(shí)施轄區(qū)醫(yī)療器械經(jīng)營(yíng)許可備案工作���,監(jiān)督轄區(qū)經(jīng)營(yíng)企業(yè)實(shí)施《醫(yī)療器械經(jīng)營(yíng)質(zhì)量管理規(guī)范》�����,組織實(shí)施對(duì)僅在本行政區(qū)域內(nèi)提供醫(yī)療器械第三方物流服務(wù)企業(yè)的現(xiàn)場(chǎng)檢查�����。根據(jù)轄區(qū)監(jiān)管實(shí)際劃分監(jiān)管職責(zé)����,指導(dǎo)���、督促轄區(qū)市場(chǎng)監(jiān)督管理所開展監(jiān)督檢查工作。
藥品審評(píng)檢查中心負(fù)責(zé)提供飛行檢查以及開展對(duì)跨行政區(qū)域提供醫(yī)療器械第三方物流服務(wù)企業(yè)現(xiàn)場(chǎng)檢查的技術(shù)支持��。
第五條??醫(yī)療器械經(jīng)營(yíng)許可和備案等相關(guān)信息�,應(yīng)當(dāng)按照信息公開要求�����,在北京市藥品監(jiān)督管理局網(wǎng)站予以公開,供申請(qǐng)人和公眾查閱。
第二章 經(jīng)營(yíng)許可與備案管理
第六條???從事第二類��、三類醫(yī)療器械經(jīng)營(yíng)的�,應(yīng)當(dāng)具備符合《監(jiān)督管理辦法》第七條設(shè)定的條件�,經(jīng)營(yíng)場(chǎng)所和庫(kù)房應(yīng)當(dāng)符合以下要求:
(一)經(jīng)營(yíng)(批發(fā))體外診斷試劑的����,應(yīng)當(dāng)具備與經(jīng)營(yíng)規(guī)模相適應(yīng)的經(jīng)營(yíng)場(chǎng)所和庫(kù)房�,且經(jīng)營(yíng)場(chǎng)所使用面積不得少于100平方米,庫(kù)房使用面積不得少于60平方米����。
(二)經(jīng)營(yíng)(批發(fā))冷鏈管理醫(yī)療器械的���,應(yīng)配備冷庫(kù),冷庫(kù)容積不得少于20立方米���。
(三)經(jīng)營(yíng)第三類醫(yī)療器械的�,應(yīng)具備與經(jīng)營(yíng)規(guī)模相適應(yīng)的經(jīng)營(yíng)場(chǎng)所和庫(kù)房:
1.經(jīng)營(yíng)植介入類產(chǎn)品的(對(duì)應(yīng)類代號(hào)為Ⅲ-6821(01、06�����、07�、08�����、09�、12)醫(yī)用電子儀器設(shè)備�、Ⅲ-6846(12、13�、16���、18、19)植入材料人工器官��、Ⅲ-6863(17)口腔科材料�、Ⅲ-6877(03����、13)介入器材產(chǎn)品)經(jīng)營(yíng)場(chǎng)所使用面積不得少于100平方米�����,庫(kù)房使用面積不得少于40平方米����。
2. 經(jīng)營(yíng)一次性無(wú)菌產(chǎn)品的(對(duì)應(yīng)經(jīng)營(yíng)類代號(hào)為Ⅲ-6815(14���、22)注射穿刺器械、Ⅲ-6845(10)體外循環(huán)及血液處理設(shè)備����、Ⅲ-6864(14)醫(yī)用衛(wèi)生材料及敷料���、Ⅲ-6865(02、18)醫(yī)用縫合材料及粘合劑����、Ⅲ-6866(08、10����、14��、18)醫(yī)用高分子材料及制品)經(jīng)營(yíng)場(chǎng)所使用面積不得少于60平方米����,庫(kù)房使用面積不得少于80平方米�����。
3.經(jīng)營(yíng)(零售)軟性角膜接觸鏡及護(hù)理用液的�,應(yīng)設(shè)有獨(dú)立的柜臺(tái)�����,經(jīng)營(yíng)場(chǎng)所使用面積不得少于30平方米����,其中提供驗(yàn)配服務(wù)的��,驗(yàn)光室(區(qū))應(yīng)具備暗室條件或滿足無(wú)直射照明的條件�����。
4.經(jīng)營(yíng)除上述類代號(hào)以外其他第三類醫(yī)療器械的���,經(jīng)營(yíng)場(chǎng)所使用面積不得少于60平方米,并配備與經(jīng)營(yíng)規(guī)模相適應(yīng)的庫(kù)房����。
(四)經(jīng)營(yíng)第二類醫(yī)療器械的����,應(yīng)配備與經(jīng)營(yíng)產(chǎn)品和規(guī)模相適應(yīng)的經(jīng)營(yíng)場(chǎng)所和庫(kù)房����。經(jīng)營(yíng)(零售)助聽器的,還應(yīng)設(shè)置單獨(dú)(免驗(yàn)配助聽器除外)的聽力檢測(cè)室�、驗(yàn)配室�����、效果評(píng)估室����。
同時(shí)經(jīng)營(yíng)(一)、(二)、(三)�����、(四)項(xiàng)所列產(chǎn)品的�,經(jīng)營(yíng)場(chǎng)所和庫(kù)房設(shè)置應(yīng)分別滿足上述最高條件���。經(jīng)營(yíng)企業(yè)貯存醫(yī)療器械的庫(kù)房應(yīng)當(dāng)各自獨(dú)立�����,不得與其他企業(yè)共用庫(kù)房及設(shè)施設(shè)備;委托提供醫(yī)療器械第三方物流服務(wù)企業(yè)的�,不視為共用庫(kù)房�。
第七條??從事第三類醫(yī)療器械經(jīng)營(yíng)的,計(jì)算機(jī)管理系統(tǒng)應(yīng)當(dāng)符合《醫(yī)療器械經(jīng)營(yíng)質(zhì)量管理規(guī)范》及醫(yī)療器械唯一標(biāo)識(shí)國(guó)家有關(guān)規(guī)定的要求���,具體要求見《北京市醫(yī)療器械經(jīng)營(yíng)質(zhì)量管理規(guī)范現(xiàn)場(chǎng)檢查評(píng)定細(xì)則》(附件1)�。
第八條 從事第三類醫(yī)療器械經(jīng)營(yíng)的�,企業(yè)應(yīng)當(dāng)向所在地區(qū)市場(chǎng)監(jiān)督管理局提出申請(qǐng)�,并通過(guò)北京市藥品監(jiān)督管理局網(wǎng)站企業(yè)服務(wù)平臺(tái)(以下簡(jiǎn)稱企業(yè)服務(wù)平臺(tái))填報(bào)《醫(yī)療器械經(jīng)營(yíng)許可申請(qǐng)表》(附件2)及有關(guān)信息�,提交符合《監(jiān)督管理辦法》第十條要求的資料���。
受理申請(qǐng)的區(qū)市場(chǎng)監(jiān)督管理局應(yīng)當(dāng)自受理之日起5個(gè)工作日內(nèi)完成對(duì)申請(qǐng)材料進(jìn)行審核����,并按照《北京市醫(yī)療器械經(jīng)營(yíng)質(zhì)量管理規(guī)范現(xiàn)場(chǎng)檢查評(píng)定細(xì)則》開展現(xiàn)場(chǎng)檢查�����。需要整改的��,企業(yè)應(yīng)當(dāng)在規(guī)定期限內(nèi)完成整改,并提交整改報(bào)告�,整改時(shí)間不計(jì)入審核時(shí)限����。
第九條 從事提供醫(yī)療器械第三方物流服務(wù)的�����,企業(yè)應(yīng)當(dāng)向所在地區(qū)市場(chǎng)監(jiān)督管理局提出申請(qǐng),并通過(guò)企業(yè)服務(wù)平臺(tái)填報(bào)《醫(yī)療器械經(jīng)營(yíng)許可申請(qǐng)表》(附件2)或《第二類醫(yī)療器械經(jīng)營(yíng)備案表》(附件3)及有關(guān)信息��,提交符合《監(jiān)督管理辦法》第十條要求的資料。
提供醫(yī)療器械第三方物流服務(wù)企業(yè)申請(qǐng)經(jīng)營(yíng)方式為為醫(yī)療器械注冊(cè)人����、備案人和經(jīng)營(yíng)企業(yè)提供醫(yī)療器械運(yùn)輸、貯存服務(wù)的《醫(yī)療器械經(jīng)營(yíng)許可證》的���,無(wú)需辦理其他事項(xiàng),即可提供第二類醫(yī)療器械運(yùn)輸���、貯存服務(wù)。
受理申請(qǐng)或備案的區(qū)市場(chǎng)監(jiān)督管理局對(duì)僅在本行政區(qū)域內(nèi)提供醫(yī)療器械第三方物流服務(wù)企業(yè),應(yīng)當(dāng)自受理之日起20個(gè)工作日內(nèi)對(duì)申請(qǐng)材料完成審核�,并按照《北京市醫(yī)療器械經(jīng)營(yíng)質(zhì)量管理規(guī)范現(xiàn)場(chǎng)檢查評(píng)定細(xì)則》開展現(xiàn)場(chǎng)檢查;?對(duì)跨行政區(qū)域從事提供醫(yī)療器械第三方物流服務(wù)企業(yè)的,應(yīng)當(dāng)自受理之日起20個(gè)工作日內(nèi)對(duì)申請(qǐng)材料完成審核�����,并由藥品審核檢查中心按照《北京市醫(yī)療器械經(jīng)營(yíng)質(zhì)量管理規(guī)范現(xiàn)場(chǎng)檢查評(píng)定細(xì)則》及時(shí)組織開展現(xiàn)場(chǎng)檢查����。需要整改的,企業(yè)應(yīng)當(dāng)在規(guī)定期限內(nèi)完成整改�����,并提交整改報(bào)告�����,整改時(shí)間不計(jì)入審核時(shí)限��。
第十條??從事第二類醫(yī)療器械經(jīng)營(yíng)的,企業(yè)應(yīng)當(dāng)向所在地區(qū)市場(chǎng)監(jiān)督管理局辦理備案�����,并通過(guò)企業(yè)服務(wù)平臺(tái)填報(bào)《第二類醫(yī)療器械經(jīng)營(yíng)備案表》(附件3)及有關(guān)信息�����,提交符合《監(jiān)督管理辦法》第十條要求的資料(第七項(xiàng)除外)����。
受理備案的區(qū)市場(chǎng)監(jiān)督管理局應(yīng)當(dāng)場(chǎng)對(duì)資料的完整性及內(nèi)容進(jìn)行審核�����,符合規(guī)定的予以備案�����,并在北京市藥品監(jiān)督管理局網(wǎng)站公示經(jīng)營(yíng)備案編號(hào)��。區(qū)市場(chǎng)監(jiān)督管理局應(yīng)當(dāng)根據(jù)《醫(yī)療器械經(jīng)營(yíng)質(zhì)量管理規(guī)范》的要求,結(jié)合轄區(qū)實(shí)際情況���,制定《第二類醫(yī)療器械經(jīng)營(yíng)企業(yè)現(xiàn)場(chǎng)檢查評(píng)定細(xì)則》���,并在自企業(yè)備案之日起3個(gè)月內(nèi)���,按照《第二類醫(yī)療器械經(jīng)營(yíng)企業(yè)現(xiàn)場(chǎng)檢查評(píng)定細(xì)則》的要求��,組織實(shí)施現(xiàn)場(chǎng)檢查�����。
第十一條??醫(yī)療器械經(jīng)營(yíng)企業(yè)跨轄區(qū)設(shè)置庫(kù)房的���,由住所所在地區(qū)市場(chǎng)監(jiān)督管理局參照《關(guān)于醫(yī)療器械經(jīng)營(yíng)企業(yè)跨行政區(qū)域設(shè)置庫(kù)房辦理事項(xiàng)的通告》(2018年 第108號(hào))的程序���,通報(bào)庫(kù)房所在地設(shè)區(qū)的市級(jí)負(fù)責(zé)藥品監(jiān)督管理的部門。
第十二條??醫(yī)療器械經(jīng)營(yíng)許可證許可��、登記事項(xiàng)變更的�����,應(yīng)當(dāng)向發(fā)證部門提出《醫(yī)療器械經(jīng)營(yíng)許可證》變更申請(qǐng)���。企業(yè)應(yīng)當(dāng)在企業(yè)服務(wù)平臺(tái)填報(bào)《醫(yī)療器械經(jīng)營(yíng)許可變更申請(qǐng)表》(見附件4),提交《監(jiān)督管理辦法》第十五條中涉及變更內(nèi)容的有關(guān)資料���。
變更登記事項(xiàng)的�,發(fā)證部門應(yīng)當(dāng)當(dāng)場(chǎng)對(duì)申請(qǐng)材料進(jìn)行審核�����,符合要求的����,予以變更����。
變更許可事項(xiàng)的��,發(fā)證部門應(yīng)當(dāng)自收到變更申請(qǐng)之日起5個(gè)工作日內(nèi)對(duì)申請(qǐng)材料進(jìn)行審核�����,按照《北京市醫(yī)療器械經(jīng)營(yíng)質(zhì)量管理規(guī)范現(xiàn)場(chǎng)檢查評(píng)定細(xì)則》開展現(xiàn)場(chǎng)檢查。對(duì)于從事提供醫(yī)療器械第三方物流服務(wù)的���,參照本細(xì)則第九條規(guī)定的程序開展現(xiàn)場(chǎng)檢查。
第十三條??第二類醫(yī)療器械經(jīng)營(yíng)企業(yè)的法定代表人(企業(yè)負(fù)責(zé)人)�、經(jīng)營(yíng)場(chǎng)所、經(jīng)營(yíng)方式���、經(jīng)營(yíng)范圍、庫(kù)房地址發(fā)生變化的��,應(yīng)及時(shí)辦理變更備案���。企業(yè)應(yīng)當(dāng)在企業(yè)服務(wù)平臺(tái)填報(bào)《第二類醫(yī)療器械經(jīng)營(yíng)備案變更表》(見附件5),按照本細(xì)則第十條提交變更內(nèi)容的有關(guān)資料��。
備案部門應(yīng)當(dāng)當(dāng)場(chǎng)對(duì)企業(yè)提交資料的完整性進(jìn)行審核����,符合規(guī)定的�����,予以備案���,變更后經(jīng)營(yíng)備案編號(hào)不變;必要時(shí)�����,可自變更之日起3個(gè)月內(nèi)按照《第二類醫(yī)療器械經(jīng)營(yíng)企業(yè)現(xiàn)場(chǎng)檢查評(píng)定細(xì)則》開展現(xiàn)場(chǎng)檢查����。
第十四條??《醫(yī)療器械經(jīng)營(yíng)許可證》有效期屆滿需要延續(xù)的��,企業(yè)應(yīng)當(dāng)按照《監(jiān)督管理辦法》第十六條的要求提出申請(qǐng)���,并通過(guò)企業(yè)服務(wù)平臺(tái)填報(bào)《醫(yī)療器械經(jīng)營(yíng)許可延續(xù)申請(qǐng)表》(見附件6),向發(fā)證部門提交《監(jiān)督管理辦法》第十條規(guī)定的有關(guān)資料�。
發(fā)證部門應(yīng)當(dāng)自收到延續(xù)申請(qǐng)之日起5個(gè)工作日內(nèi)對(duì)申請(qǐng)材料完成審核,按照《北京市醫(yī)療器械經(jīng)營(yíng)質(zhì)量管理規(guī)范現(xiàn)場(chǎng)檢查評(píng)定細(xì)則》開展現(xiàn)場(chǎng)檢查����。對(duì)于從事提供醫(yī)療器械第三方物流服務(wù)的����,參照本細(xì)則第九條規(guī)定的程序開展現(xiàn)場(chǎng)檢查�����。
第十五條??企業(yè)無(wú)違法違規(guī)經(jīng)營(yíng)行為主動(dòng)放棄經(jīng)營(yíng)的�,應(yīng)當(dāng)向原發(fā)證部門或備案部門提出醫(yī)療器械經(jīng)營(yíng)資格注銷或標(biāo)注��,并通過(guò)企業(yè)服務(wù)平臺(tái)填報(bào)《醫(yī)療器械經(jīng)營(yíng)許可證注銷申請(qǐng)表》(見附件7)或《第二類醫(yī)療器械經(jīng)營(yíng)備案標(biāo)注申請(qǐng)表》(見附件8)�����,提交相關(guān)證明性資料�����。發(fā)證部門或備案部門應(yīng)當(dāng)依法注銷或標(biāo)注其醫(yī)療器械經(jīng)營(yíng)資格�����。
第十六條??委托提供醫(yī)療器械第三方物流服務(wù)企業(yè)貯存配送的,在辦理醫(yī)療器械經(jīng)營(yíng)許可或備案時(shí)�����,應(yīng)當(dāng)提交與被委托方簽訂的含有明確雙方質(zhì)量責(zé)任內(nèi)容的書面協(xié)議����、被委托方的《醫(yī)療器械經(jīng)營(yíng)許可證》復(fù)印件,不需提交《監(jiān)督管理辦法》第十條第四款關(guān)于庫(kù)房的相關(guān)材料�����。
第十七條??《醫(yī)療器械經(jīng)營(yíng)許可證》遺失的����,企業(yè)應(yīng)當(dāng)通過(guò)企業(yè)服務(wù)平臺(tái)填報(bào)《醫(yī)療器械經(jīng)營(yíng)許可證補(bǔ)發(fā)申請(qǐng)表》(見附件9)��,向發(fā)證部門申請(qǐng)補(bǔ)發(fā)�。發(fā)證部門應(yīng)當(dāng)對(duì)申請(qǐng)材料進(jìn)行審核�����,符合要求的��,予以補(bǔ)發(fā)����,補(bǔ)發(fā)的醫(yī)療器械經(jīng)營(yíng)許可證編號(hào)和有效期與原證一致��?����!兜诙愥t(yī)療器械經(jīng)營(yíng)備案憑證》遺失的�����,企業(yè)應(yīng)當(dāng)通過(guò)企業(yè)服務(wù)平臺(tái)填報(bào)《第二類醫(yī)療器械經(jīng)營(yíng)備案憑證補(bǔ)發(fā)表》(見附件10),向備案部門辦理補(bǔ)發(fā)手續(xù)�����。備案部門應(yīng)當(dāng)當(dāng)場(chǎng)對(duì)相關(guān)材料進(jìn)行審核�,符合要求的��,予以補(bǔ)發(fā)��,補(bǔ)發(fā)的第二類醫(yī)療器械經(jīng)營(yíng)備案憑證編號(hào)與原憑證一致�。
第十八條??企業(yè)因違法經(jīng)營(yíng)醫(yī)療器械被市場(chǎng)監(jiān)督管理部門立案調(diào)查尚未結(jié)案的�,或者收到行政處罰決定尚未履行的����,區(qū)市場(chǎng)監(jiān)督管理局應(yīng)當(dāng)中止相關(guān)許可��,直至案件處理完畢。
第十九條??企業(yè)有下列情形之一的��,所在地區(qū)市場(chǎng)監(jiān)督管理局應(yīng)當(dāng)注銷其《醫(yī)療器械經(jīng)營(yíng)許可證》或在其第二類醫(yī)療器械備案信息中予以標(biāo)注���。
(一)企業(yè)不具備原經(jīng)營(yíng)條件或者與備案信息不符且無(wú)法取得聯(lián)系的,經(jīng)公示滿60日后��,仍無(wú)聯(lián)系的����;
(二)獲知企業(yè)的《營(yíng)業(yè)執(zhí)照》已被依法注銷���,但企業(yè)未向所在地區(qū)市場(chǎng)監(jiān)督管理局申請(qǐng)注銷或標(biāo)注《醫(yī)療器械經(jīng)營(yíng)許可證》或備案編號(hào)的;
(三)《醫(yī)療器械經(jīng)營(yíng)許可證》有效期屆滿未延續(xù)的�;
(四)《醫(yī)療器械經(jīng)營(yíng)許可證》被依法撤銷�����、撤回、吊銷的�����;
(五)法律、法規(guī)規(guī)定其他情形的�。
第三章 經(jīng)營(yíng)質(zhì)量管理
第二十條??提供醫(yī)療器械第三方物流服務(wù)企業(yè)除符合《醫(yī)療器械經(jīng)營(yíng)質(zhì)量管理規(guī)范》的要求以外��,還應(yīng)當(dāng)滿足以下條件:
(一)用于提供醫(yī)療器械貯存服務(wù)的庫(kù)房使用總面積不得低于3000平方米�����,可以設(shè)置多個(gè)分庫(kù)房����,其中主庫(kù)房使用面積不得低于1500平方米��,分庫(kù)房使用面積不得低于500平方米����,并具備與業(yè)務(wù)范圍規(guī)模相適應(yīng)的貯存條件;
(二)具備現(xiàn)代物流儲(chǔ)運(yùn)設(shè)施設(shè)備���;
(三)具備醫(yī)療器械信息化物流綜合管理系統(tǒng)��,至少應(yīng)當(dāng)包括倉(cāng)庫(kù)管理系統(tǒng)�����、運(yùn)輸管理系統(tǒng),提供醫(yī)療器械冷鏈運(yùn)輸服務(wù)的����,還應(yīng)當(dāng)建立冷鏈運(yùn)輸追溯系統(tǒng)。
醫(yī)療器械信息化物流綜合管理系統(tǒng)應(yīng)能對(duì)醫(yī)療器械的貯存��、運(yùn)輸全過(guò)程質(zhì)量信息實(shí)行動(dòng)態(tài)管理和控制�,對(duì)相關(guān)數(shù)據(jù)可進(jìn)行收集�、記錄��、查詢�����。數(shù)據(jù)采集應(yīng)完整���、及時(shí)�����、準(zhǔn)確���,并可制作相關(guān)統(tǒng)計(jì)報(bào)表��。具有與委托方實(shí)時(shí)同步電子數(shù)據(jù)的功能��,可實(shí)現(xiàn)貯存、運(yùn)輸全過(guò)程的追溯管理�。
第二十一條??醫(yī)療器械經(jīng)營(yíng)企業(yè)委托提供醫(yī)療器械第三方物流服務(wù)企業(yè)運(yùn)輸貯存的,委托方應(yīng)當(dāng)承擔(dān)質(zhì)量管理責(zé)任����,可根據(jù)經(jīng)營(yíng)品種及規(guī)模委托不同的企業(yè)提供服務(wù)���,并在《醫(yī)療器械經(jīng)營(yíng)許可證》或備案信息的庫(kù)房地址中標(biāo)注“委托‘承接委托企業(yè)名稱’貯存”后,方可開展業(yè)務(wù)�����。
對(duì)于已中止委托的或委托協(xié)議到期未延續(xù)的,提供醫(yī)療器械第三方物流服務(wù)企業(yè)應(yīng)當(dāng)及時(shí)書面告知所在地區(qū)市場(chǎng)監(jiān)督管理局�,由所在地區(qū)市場(chǎng)監(jiān)督管理局告知委托方所在地設(shè)區(qū)的市級(jí)負(fù)責(zé)藥品監(jiān)督管理的部門����。
第二十二條??提供醫(yī)療器械第三方物流服務(wù)企業(yè)的貯存條件應(yīng)當(dāng)與委托貯存品種的條件相匹配,且不得接受其他提供醫(yī)療器械第三方物流服務(wù)企業(yè)的委托�。
僅在本行政區(qū)域內(nèi)從事提供醫(yī)療器械第三方物流服務(wù)企業(yè)的�����,不得接受本行政區(qū)域以外醫(yī)療器械經(jīng)營(yíng)企業(yè)的委托����。
第二十三條??醫(yī)療器械經(jīng)營(yíng)企業(yè)和提供醫(yī)療器械第三方物流服務(wù)企業(yè)自行開展運(yùn)輸服務(wù)的�����,應(yīng)當(dāng)在醫(yī)療器械運(yùn)輸過(guò)程中采取有效的質(zhì)量控制措施����,實(shí)現(xiàn)醫(yī)療器械運(yùn)輸全過(guò)程質(zhì)量可控、可追溯���。
第二十四條??醫(yī)療器械經(jīng)營(yíng)企業(yè)和提供醫(yī)療器械第三方物流服務(wù)企業(yè)委托其他具備質(zhì)量保障能力的承運(yùn)單位運(yùn)輸醫(yī)療器械的,應(yīng)當(dāng)建立醫(yī)療器械委托運(yùn)輸管理制度和運(yùn)輸質(zhì)量評(píng)審管理制度,與承運(yùn)單位簽訂委托協(xié)議����,明確雙方質(zhì)量責(zé)任、操作規(guī)程與在途時(shí)限等內(nèi)容����,對(duì)委托承運(yùn)單位每年至少開展一次評(píng)審�,評(píng)審內(nèi)容至少包括運(yùn)輸設(shè)備設(shè)施����、質(zhì)量管理水平�����、風(fēng)險(xiǎn)控制能力等��,對(duì)承運(yùn)單位評(píng)審結(jié)果不符合要求的�,應(yīng)當(dāng)與其停止合作。
第二十五條 鼓勵(lì)提供醫(yī)療器械第三方物流服務(wù)企業(yè)通過(guò)建立信息化系統(tǒng)向全社會(huì)實(shí)施公示貯存運(yùn)輸服務(wù)能力信息���,方便醫(yī)療器械經(jīng)營(yíng)企業(yè)查詢、合作��。
第二十六條??醫(yī)療器械經(jīng)營(yíng)企業(yè)和提供醫(yī)療器械第三方物流服務(wù)企業(yè)運(yùn)輸有特殊溫度要求醫(yī)療器械的���,應(yīng)當(dāng)對(duì)醫(yī)療器械進(jìn)行妥善包裝,并根據(jù)距離等因素評(píng)估和確定送達(dá)期限�����;根據(jù)業(yè)務(wù)類型��、范圍和送達(dá)時(shí)限選擇合適的運(yùn)輸工具���、運(yùn)輸設(shè)備和運(yùn)輸包裝。對(duì)于冷鏈管理的醫(yī)療器械��,運(yùn)輸過(guò)程應(yīng)當(dāng)符合本細(xì)則《冷鏈醫(yī)療器械運(yùn)輸貯存管理檢查評(píng)定細(xì)則》的有關(guān)要求��,防止脫離冷鏈����。
第二十七條??第三類醫(yī)療器械經(jīng)營(yíng)企業(yè)和提供醫(yī)療器械第三方物流服務(wù)企業(yè)應(yīng)當(dāng)建立質(zhì)量管理自查制度��,按照醫(yī)療器械經(jīng)營(yíng)質(zhì)量管理規(guī)范的要求進(jìn)行全項(xiàng)目自查��,并通過(guò)企業(yè)服務(wù)平臺(tái)向所在地區(qū)市場(chǎng)監(jiān)督管理局提交年度自查報(bào)告����。
年度自查報(bào)告至少應(yīng)當(dāng)包含以下內(nèi)容:
(一)醫(yī)療器械經(jīng)營(yíng)質(zhì)量管理規(guī)范年度運(yùn)行情況�;
(二)醫(yī)療器械產(chǎn)品年度經(jīng)營(yíng)情況;
(三)進(jìn)口醫(yī)療器械產(chǎn)品經(jīng)營(yíng)情況(僅限進(jìn)口總代理商報(bào)送)�;
(四)上一年度醫(yī)療器械委托運(yùn)輸貯存服務(wù)業(yè)務(wù)開展情況(僅限提供醫(yī)療器械第三方物流服務(wù)企業(yè))����。
第二十八條??提供醫(yī)療器械第三方物流服務(wù)企業(yè)自行停業(yè)或恢復(fù)經(jīng)營(yíng)的����,應(yīng)當(dāng)及時(shí)書面告知所在地區(qū)市場(chǎng)監(jiān)督管理局��;恢復(fù)經(jīng)營(yíng)的��,應(yīng)當(dāng)經(jīng)現(xiàn)場(chǎng)檢查符合要求后,方可開展醫(yī)療器械經(jīng)營(yíng)業(yè)務(wù)����。
第二十九條 區(qū)市場(chǎng)監(jiān)督管理局應(yīng)當(dāng)對(duì)轄區(qū)醫(yī)療器械經(jīng)營(yíng)企業(yè)和提供醫(yī)療器械第三方物流服務(wù)企業(yè)實(shí)施分類分級(jí)管理���,并建立轄區(qū)年度醫(yī)療器械經(jīng)營(yíng)日常監(jiān)督計(jì)劃。對(duì)轄區(qū)企業(yè)實(shí)施醫(yī)療器械經(jīng)營(yíng)質(zhì)量管理規(guī)范的情況進(jìn)行監(jiān)督檢查�;對(duì)第三類醫(yī)療器械經(jīng)營(yíng)企業(yè)和提供醫(yī)療器械第三方物流服務(wù)企業(yè)的年度自查報(bào)告進(jìn)行審查;規(guī)范企業(yè)經(jīng)營(yíng)行為���,對(duì)有不良記錄的企業(yè)實(shí)施重點(diǎn)監(jiān)管。
第三十條 有下列情形之一的���,區(qū)市場(chǎng)監(jiān)督管理局可增加現(xiàn)場(chǎng)檢查頻次:
(一)上一年度新開辦的第三類經(jīng)營(yíng)企業(yè)��;
(二)上一年度監(jiān)督檢查中發(fā)現(xiàn)存在嚴(yán)重問(wèn)題的;
(三)未提交年度自查報(bào)告或通過(guò)審查年度自查報(bào)告發(fā)現(xiàn)存在重大質(zhì)量安全風(fēng)險(xiǎn)隱患的�����。
第三十一條??區(qū)市場(chǎng)監(jiān)督管理局應(yīng)當(dāng)加強(qiáng)對(duì)投訴舉報(bào)較多�����、監(jiān)督檢查或者其他信息顯示存在重大質(zhì)量安全風(fēng)險(xiǎn)隱患企業(yè)的飛行檢查��。
第三十二條??醫(yī)療器械經(jīng)營(yíng)許可證的編號(hào)規(guī)則為:京X1藥監(jiān)械經(jīng)營(yíng)許XXXX2XXXX3號(hào)���;醫(yī)療器械經(jīng)營(yíng)備案的編號(hào)規(guī)則為:京X1藥監(jiān)械經(jīng)營(yíng)備XXXX2XXXX3號(hào)。其中:X1為企業(yè)所在地區(qū)的簡(jiǎn)稱����,XXXX2為許可或備案年份,XXXX3為許可或備案流水號(hào)�����。
第三十三條??醫(yī)療器械經(jīng)營(yíng)許可分為第三類醫(yī)療器械經(jīng)營(yíng)和提供醫(yī)療器械第三方物流服務(wù)兩種業(yè)務(wù)模式�,同時(shí)申請(qǐng)上述兩種業(yè)務(wù)模式許可的���,執(zhí)行提供醫(yī)療器械第三方物流服務(wù)企業(yè)的審批時(shí)限�。
第三十四條??對(duì)于已取得《醫(yī)療器械經(jīng)營(yíng)許可證》的企業(yè)或同時(shí)申請(qǐng)醫(yī)療器械經(jīng)營(yíng)許可和辦理經(jīng)營(yíng)備案的企業(yè),在辦理醫(yī)療器械經(jīng)營(yíng)備案事項(xiàng)時(shí),已在其許可事項(xiàng)中已提交的申請(qǐng)材料可不重復(fù)提交�����,并豁免經(jīng)營(yíng)備案現(xiàn)場(chǎng)檢查�。
對(duì)于醫(yī)療器械經(jīng)營(yíng)企業(yè)和提供醫(yī)療器械第三方物流服務(wù)企業(yè)在辦理變更經(jīng)營(yíng)場(chǎng)所和庫(kù)房地址時(shí)����,如僅涉及地址名稱變更而不涉及實(shí)際地址變更的,以及經(jīng)營(yíng)企業(yè)核減經(jīng)營(yíng)范圍���、經(jīng)營(yíng)方式的,可豁免現(xiàn)場(chǎng)檢查�����。
對(duì)于統(tǒng)一采購(gòu)渠道�,采取連鎖經(jīng)營(yíng)的非法人醫(yī)療器械零售企業(yè)��,不需單獨(dú)設(shè)立質(zhì)量負(fù)責(zé)人�����,可由連鎖企業(yè)總部統(tǒng)一進(jìn)行質(zhì)量管理。
第三十五條??本細(xì)則自發(fā)布之日起施行�。北京市食品藥品監(jiān)督管理局發(fā)布的《北京市〈醫(yī)療器械經(jīng)營(yíng)監(jiān)督管理辦法〉實(shí)施細(xì)則(2017年修訂版)》同時(shí)廢止�。
附件:1.北京市醫(yī)療器械經(jīng)營(yíng)質(zhì)量管理規(guī)范現(xiàn)場(chǎng)檢查評(píng)定細(xì)則
2.醫(yī)療器械經(jīng)營(yíng)許可申請(qǐng)表
3.第二類醫(yī)療器械經(jīng)營(yíng)備案表
4.醫(yī)療器械經(jīng)營(yíng)許可變更申請(qǐng)表
5.第二類醫(yī)療器械經(jīng)營(yíng)備案變更表
6.醫(yī)療器械經(jīng)營(yíng)許可延續(xù)申請(qǐng)表
7.醫(yī)療器械經(jīng)營(yíng)許可證注銷申請(qǐng)表
8.第二類醫(yī)療器械經(jīng)營(yíng)備案憑證標(biāo)注表
9.醫(yī)療器械經(jīng)營(yíng)許可證補(bǔ)發(fā)申請(qǐng)表
10.第二類醫(yī)療器械經(jīng)營(yíng)備案憑證補(bǔ)發(fā)表
北京市醫(yī)療器械經(jīng)營(yíng)監(jiān)督管理辦法實(shí)施細(xì)則修訂說(shuō)明
醫(yī)療器械直接關(guān)系人民群眾生命健康�����,國(guó)家市場(chǎng)監(jiān)管總局���、國(guó)家藥監(jiān)局、市委�、市政府高度重視醫(yī)療器械質(zhì)量安全�。2022年2月18日國(guó)家市場(chǎng)監(jiān)管總局第4次局務(wù)會(huì)審議通過(guò)《醫(yī)療器械經(jīng)營(yíng)監(jiān)督管理辦法》(以下簡(jiǎn)稱《辦法》)。為貫徹落實(shí)新修訂的《辦法》���,適應(yīng)新形勢(shì)下醫(yī)療器械經(jīng)營(yíng)監(jiān)管工作需要,落實(shí)企業(yè)主體責(zé)任,強(qiáng)化監(jiān)管措施力度,規(guī)范醫(yī)療器械經(jīng)營(yíng)活動(dòng),保障醫(yī)療器械產(chǎn)品質(zhì)量安全,北京市藥監(jiān)局結(jié)合行業(yè)監(jiān)管和發(fā)展實(shí)際情況,組織修訂形成了《北京市醫(yī)療器械經(jīng)營(yíng)監(jiān)督管理辦法實(shí)施細(xì)則》(征求意見稿)(以下簡(jiǎn)稱《細(xì)則》)���。
2022年3月��,北京市藥監(jiān)局啟動(dòng)《細(xì)則》的修訂工作,深入基層調(diào)研��,廣泛聽取各區(qū)藥品監(jiān)督管理部門��、醫(yī)療器械經(jīng)營(yíng)企業(yè)���、醫(yī)藥行業(yè)協(xié)會(huì)意見��,委托藥品審查中心開展課題研究,在多次研究論證和反復(fù)修改后形成了《細(xì)則》�。
2022年4月,內(nèi)部征求部分區(qū)藥品監(jiān)督管理部門及醫(yī)療器械經(jīng)營(yíng)企業(yè)意見�,并根據(jù)反饋意見建議���,研究修訂完善�����。6月內(nèi)部征求各區(qū)藥品監(jiān)督管理部門意見����。6月-9月,通過(guò)實(shí)地走訪醫(yī)療器械經(jīng)營(yíng)企業(yè)�,召開部分區(qū)藥品監(jiān)督管理部門座談會(huì)等�,聽取基層對(duì)《細(xì)則》的意見建議。
2022年9月����,北京市藥監(jiān)局再次全面梳理和完善《細(xì)則》并向全社會(huì)公開征求意見��。
一是全面落實(shí)新《辦法》要求。全面落實(shí)新《辦法》和國(guó)家市場(chǎng)監(jiān)管總局�����、國(guó)家藥監(jiān)局��、市委�����、市政府關(guān)于加強(qiáng)醫(yī)療器械監(jiān)管工作的最新要求���,對(duì)與新《辦法》不相一致的內(nèi)容進(jìn)行修改��,補(bǔ)充完善相關(guān)規(guī)定��。
二是堅(jiān)決貫徹“四個(gè)最嚴(yán)”要求�。結(jié)合醫(yī)療器械經(jīng)營(yíng)監(jiān)管工作實(shí)際,以問(wèn)題為導(dǎo)向���,厘清事權(quán)、強(qiáng)化責(zé)任����,對(duì)制約監(jiān)管的突出問(wèn)題進(jìn)行針對(duì)性的補(bǔ)充,解決監(jiān)管急需����,提高監(jiān)管效能。
三是深化推進(jìn)“放管服”改革���。力求體現(xiàn)和適應(yīng)行政審批制度改革的需要�,簡(jiǎn)化許可和備案程序���,鞏固“放管服”改革成果�����,釋放市場(chǎng)創(chuàng)新活力。
四是嚴(yán)格落實(shí)企業(yè)主體責(zé)任�����。通過(guò)細(xì)化基本監(jiān)管制度���、強(qiáng)化風(fēng)險(xiǎn)管控理念��,夯實(shí)企業(yè)主體責(zé)任。
(一)落實(shí)“放管服”要求,簡(jiǎn)化辦理流程
《細(xì)則》取消了原《細(xì)則》中將原來(lái)的申請(qǐng)經(jīng)營(yíng)方式為批發(fā)��、零售以及批零兼營(yíng)的經(jīng)營(yíng)許可事項(xiàng),由30工作日內(nèi)對(duì)申請(qǐng)資料進(jìn)行審核��,調(diào)整為自受理之日起5個(gè)工作日內(nèi)作出決定�����。對(duì)于原《細(xì)則》提供醫(yī)療器械第三方物流服務(wù)企業(yè)的庫(kù)房面積不低于3000平方米�����,改為庫(kù)房使用總面積不得低于3000平方米�����,可以設(shè)置多個(gè)分庫(kù)房�����,其中主庫(kù)房使用面積不得低于1500平方米��,分庫(kù)房使用面積不得低于500平方米�����,降低企業(yè)申請(qǐng)成本。對(duì)于同時(shí)申請(qǐng)三類經(jīng)營(yíng)許可和辦理二類經(jīng)營(yíng)備案程序���,提交一次資料,一并完成現(xiàn)場(chǎng)核查規(guī)定���。
(二)明確監(jiān)管事權(quán)��,強(qiáng)化監(jiān)管舉措
《細(xì)則》明確各區(qū)藥品監(jiān)督管理部門組織開展轄區(qū)醫(yī)療器械經(jīng)營(yíng)企業(yè)以及提供醫(yī)療器械第三方物流服務(wù)企業(yè)的監(jiān)督管理�����,實(shí)施轄區(qū)醫(yī)療器械經(jīng)營(yíng)許可備案工作,監(jiān)督轄區(qū)經(jīng)營(yíng)企業(yè)實(shí)施《醫(yī)療器械經(jīng)營(yíng)質(zhì)量管理規(guī)范》���,組織實(shí)施對(duì)僅在本行政區(qū)域內(nèi)提供醫(yī)療器械第三方物流服務(wù)企業(yè)的現(xiàn)場(chǎng)檢查���。根據(jù)轄區(qū)監(jiān)管實(shí)際劃分監(jiān)管職責(zé),指導(dǎo)��、督促轄區(qū)市場(chǎng)監(jiān)督管理所開展監(jiān)督檢查工作�����。
藥品審評(píng)檢查中心負(fù)責(zé)提供飛行檢查以及開展對(duì)跨行政區(qū)域提供醫(yī)療器械第三方物流服務(wù)企業(yè)現(xiàn)場(chǎng)檢查的技術(shù)支持�����。
(三)探索智慧監(jiān)管��,促進(jìn)行業(yè)自律
《細(xì)則》提出醫(yī)療器械信息化物流綜合管理系統(tǒng)應(yīng)能對(duì)醫(yī)療器械的貯存�����、運(yùn)輸全過(guò)程質(zhì)量信息實(shí)行動(dòng)態(tài)管理和控制���,對(duì)相關(guān)數(shù)據(jù)可進(jìn)行收集、記錄�����、查詢����。同時(shí)�����,鼓勵(lì)提供醫(yī)療器械第三方物流服務(wù)企業(yè)通過(guò)建立信息化系統(tǒng)向全社會(huì)實(shí)施公示貯存運(yùn)輸服務(wù)能力信息�����,方便醫(yī)療器械經(jīng)營(yíng)企業(yè)查詢���、合作�。
(四)增加監(jiān)管措施�,強(qiáng)化監(jiān)管手段
《細(xì)則》規(guī)定對(duì)于上一年度新開辦的第三類經(jīng)營(yíng)企業(yè)��、上一年度監(jiān)督檢查中發(fā)現(xiàn)存在嚴(yán)重問(wèn)題的�、未提交年度自查報(bào)告或通過(guò)審查年度自查報(bào)告發(fā)現(xiàn)存在重大質(zhì)量安全風(fēng)險(xiǎn)隱患的企業(yè),區(qū)市場(chǎng)監(jiān)督管理局可增加現(xiàn)場(chǎng)檢查頻次�����;對(duì)于投訴舉報(bào)較多����、監(jiān)督檢查或者其他信息顯示存在重大質(zhì)量安全風(fēng)險(xiǎn)隱患的企業(yè)����,區(qū)市場(chǎng)監(jiān)督管理局應(yīng)當(dāng)對(duì)其開展飛行檢查����。
附件3: