受理號:CSZ1900206
體外診斷試劑產(chǎn)品注冊技術(shù)審評報(bào)告
產(chǎn)品中文名稱:乙型肝炎病毒 RNA(HBV-RNA)測定試劑盒(PCR-熒光探針法)
申請人名稱:北京熱景生物技術(shù)股份有限公司
國家藥品監(jiān)督管理局
醫(yī)療器械技術(shù)審評中心
基本信息
北京市大興區(qū)中關(guān)村科技園區(qū)大興生物醫(yī)藥產(chǎn)業(yè)基地天富街?9?號?9?幢
北京市大興區(qū)中關(guān)村科技園區(qū)大興生物醫(yī)藥產(chǎn)業(yè)基地天富街?9?號?9?幢
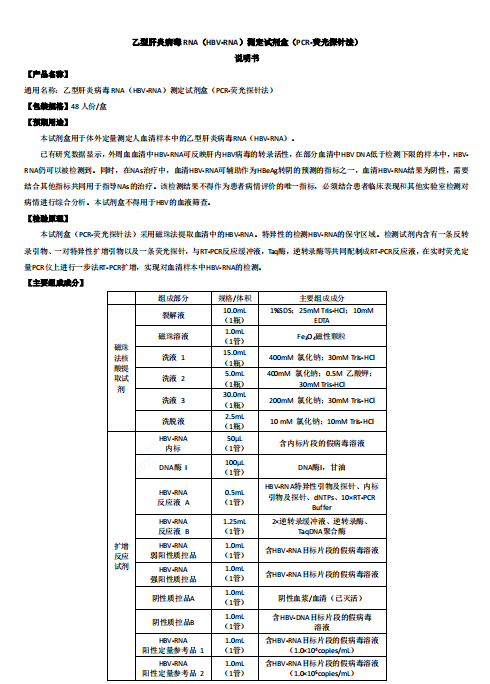
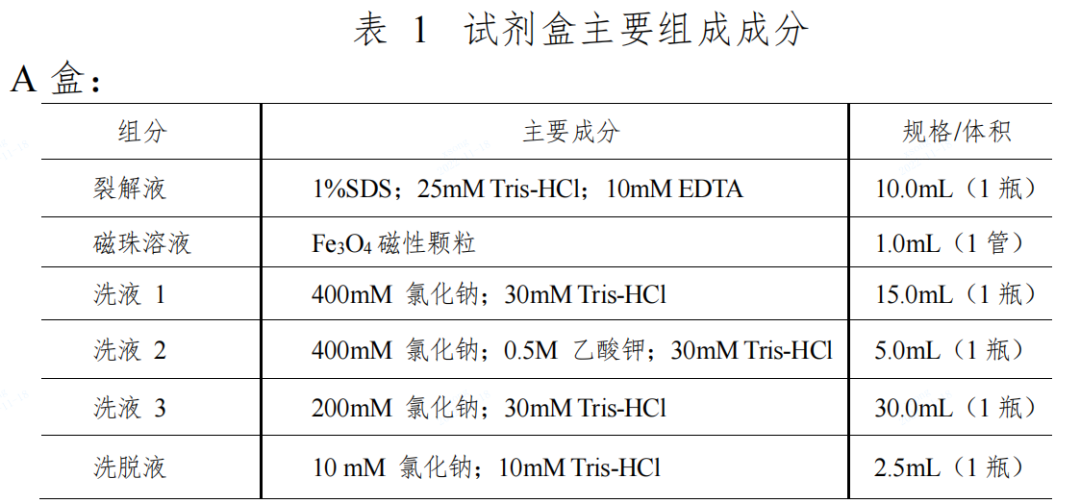
本試劑盒由?A?盒(磁珠法核酸提取試劑)和?B?盒(擴(kuò)增反應(yīng)試劑)組成��,主要組成成分見表1�。
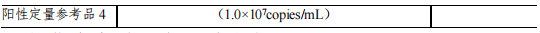
本試劑盒用于體外定量測定人血清樣本中的乙型肝炎病毒 RNA(HBV-RNA)�����。
已有研究數(shù)據(jù)顯示���,外周血血清中 HBV-RNA 可反映肝內(nèi) HBV 病毒的轉(zhuǎn)錄活性�����,在部分血清中HBV DNA 低于檢測下限的樣本中����,HBV-RNA 仍可以被檢測到����。同時(shí)�,在NAs治療中,血清HBV-RNA 可輔助作為 HBeAg 轉(zhuǎn)陰的預(yù)測的指標(biāo)之一,血清 HBV-RNA 結(jié)果為陰性�����,需要結(jié)合其他指標(biāo)共同用于指導(dǎo) NAs 的治療�����。該檢測結(jié)果不得作為患者病情評價(jià)的唯一指標(biāo)��,必須結(jié)合患者臨床表現(xiàn)和其他實(shí)驗(yàn)室檢測對病情進(jìn)行綜合分析����。本試劑盒不得用于 HBV 的血液篩查���。
本試劑盒(PCR-熒光探針法)采用磁珠法提取血清中的 HBV-RNA�。特異性地檢測 HBV-RNA 的保守區(qū)域。檢測試劑內(nèi)含有一條反轉(zhuǎn)錄引物�、一對特異性擴(kuò)增引物以及一條熒光探針,與 RT-PCR 反應(yīng)緩沖液�,Taq 酶�,逆轉(zhuǎn)錄酶等共同配制成 RT-PCR 反應(yīng)液,在實(shí)時(shí)熒光定量 PCR 儀上進(jìn)行一步法 RT-PCR 擴(kuò)增����,實(shí)現(xiàn)對血清樣本中 HBV-RNA 的檢測。
本產(chǎn)品的主要原材料包括:引物、探針�、假病毒、RT-PCR 反應(yīng)體系(包括 10×RT-PCR Buffer(含 dNTPs)��、逆轉(zhuǎn)錄酶和 TaqDNA 聚合酶混合液)�、磁珠法核酸提取試劑等���,這些原材料均是通過外購方式獲得�����。其中����,引物和探針均為申請人自行設(shè)計(jì)�,由專業(yè)的合成公司合成和純化后獲得。
申請人從有資質(zhì)的供應(yīng)商中�����,通過功能性試驗(yàn)���,篩選出最佳原材料和供應(yīng)商��。制定了各主要原材料質(zhì)量標(biāo)準(zhǔn)并經(jīng)檢驗(yàn)合格���。
該產(chǎn)品企業(yè)參考品包括陽性參考品�、陰性參考品、精密度參考品�����、檢出限參考品�、準(zhǔn)確度參考品、樣本線性參考品�����、核酸提取功能參考品����,參考品采用臨床樣本制備而成。組成如下:
陽性參考品共 10?份�,分別命名為陽性參考品 P1~P10�,來源于 HBV-RNA 陽性樣本��,涵蓋B型��、C型和D型����。
陰性參考品共10份,分別命名為陰性參考品?N1~N10�����,涵蓋正常人樣本����、巨細(xì)胞病毒����、EB病毒�����、人類免疫缺陷病毒1型���、丙型肝炎病毒、甲型肝炎病毒和梅毒樣本���。
精密度參考品共 2 份,分別命名為精密度參考品 J1~J2�����,采用 HBV-RNA 陽性樣本梯度稀釋而成��。
檢出限參考品?1?份���,命名為檢出限參考品?S1,采用?HBV-RNA 陽性樣本稀釋而成��,濃度為 300copies/mL ��。
準(zhǔn)確度參考品共 5 份�,分別命名為準(zhǔn)確度參考品 Y1~Y5�,采用 HBV-RNA 陽性樣本梯度稀釋而成���,濃度分別為2.0×107copies/mL、 2.0×106copies/mL ����、2.0×105copies/mL �����、2.0×104copies/mL��、2.0×103copies/mL��。
樣本線性參考品 1 份����,命名為樣本線性參考品 L����,采用 HBV-RNA 陽性樣本稀釋而成。
核酸提取功能參考品共 12 份���,分別命名為核酸提取功能參考品 T1~T12���,其中 T1~T8 采用含內(nèi)源性干擾物質(zhì)的 HBV- RNA 陽性樣本稀釋而成,T1�、T5、T9 含血紅蛋白���,T2�、T6���、 T10?含甘油三脂,T3����、T7、T11 含總 IgG�,T4、T8��、T12 含?總膽紅素���,T9~T12 為陰性血清樣本����。
以上臨床樣本采用數(shù)字 PCR 法和實(shí)時(shí)熒光 PCR 法進(jìn)行確認(rèn)���。各企業(yè)參考品用于產(chǎn)品準(zhǔn)確性��、特異性、檢出限��、精密度����、線性�����、核酸提取功能等的檢測���。
本試劑盒設(shè)置了陽性質(zhì)控品和陰性質(zhì)控品,用于檢測過程中試劑盒和儀器的質(zhì)量控制����。此外�����,每個(gè)樣本均檢測 1 個(gè)?內(nèi)標(biāo)���,用于評估核酸提取和 PCR 擴(kuò)增的質(zhì)量和結(jié)果的判讀。
(二)生產(chǎn)工藝及反應(yīng)體系研究
申請人對試劑盒反應(yīng)體系的研究包括對 HBV-RNA?特異性引物/探針濃度的確定���、內(nèi)標(biāo)引物/探針濃度的確定、反應(yīng)液的選擇�����、反應(yīng)體積的確定�����、核酸提取試劑的確定�、DNA 酶 I 的用量確定等;對反應(yīng)條件的研究包括 PCR 退火溫度����、擴(kuò)增循環(huán)數(shù)、擴(kuò)增反應(yīng)時(shí)間�,DNA 酶 I 的作用溫度和時(shí)間的篩選和優(yōu)化;對樣本用量��、內(nèi)標(biāo)用量�、核酸提取液體積等進(jìn)行了研究�。
申請人通過功能性實(shí)驗(yàn),確定了最佳的反應(yīng)體系����。并根據(jù)試劑盒中試劑及組件的主要生產(chǎn)工藝的研究結(jié)果,確定了最佳的生產(chǎn)工藝�����。
該產(chǎn)品分析性能評估內(nèi)容包括核酸提取功能����、檢出限���、線性范圍、準(zhǔn)確度���、精密度��、分析特異性(交叉反應(yīng)�����、干擾物質(zhì))�����、HBV DNA 干擾濃度等���。申請人提交了有效運(yùn)行的質(zhì)量管 理體系下生產(chǎn)的三批產(chǎn)品在 3 種適用機(jī)型( ABI Prism7500、LightCycler480�����、杭州博日 9600plus)上的性能評估資料�����。
在核酸提取功能評估中����,申請人使用含有 28mg/dL 總膽紅素、22g/dL 血紅蛋白����、3000mg/dL 甘油三酯、40g/L 總 IgG 的 HBV-RNA 陰性血清樣本稀釋已知濃度的HBV-RNA 強(qiáng)陽性樣本��,制備成高�����、低濃度樣本進(jìn)行研究���,結(jié)果表明以上干擾物質(zhì)對核酸提取性能無影響。
在檢出限的性能評估中�����,申請人對 HBV-RNA?臨床血清樣本(B 型�、C 型、D 型)和 HBV-RNA 假病毒樣本(A 型��、E 型、F ?型��、G 型)進(jìn)行梯度稀釋,采用三批次試劑對系列濃度樣本分別進(jìn)行 20?次重復(fù)檢測���,以≥95%陽性檢出率的最低稀釋濃度作為檢出限����,最終確定該產(chǎn)品檢出限為 300copies/mL�����。采用三批試劑對 HBV-RNA 臨床血清樣本(B 型�����、C 型�、D 型)和 HBV-RNA 假病毒樣本(A 型���、E 型����、F 型��、G型)進(jìn)行檢出限的重復(fù)性檢測驗(yàn)證���,符合檢出限的性能要求��。
在線性范圍的性能評估中����,申請人采用不同基因型的樣本�����,分別制備?9?個(gè)濃度的樣本進(jìn)行線性范圍研究��,產(chǎn)品在1.0×103copies/mL~1.0×108copies/mL 范圍濃度呈線性相關(guān)��,線性相關(guān)系數(shù) r>0.9800���,符合線性范圍的性能要求。
在準(zhǔn)確度的性能評估中���,申請人采用?HBV-RNA?陰性樣本對陽性樣本進(jìn)行系列稀釋,分別制備成?2.0×107?copies/mL�����、2.0?× 106 copies/mL �、2.0?× 105 copies/mL 、2.0?× 104 copies/mL����、2.0×103 copies/mL 共 5 個(gè)梯度樣本進(jìn)行準(zhǔn)確度研究,結(jié)果表明檢測濃度的對數(shù)值與理論濃度的對數(shù)值的絕對偏差不超過±0.5個(gè)對數(shù)數(shù)量級����,符合準(zhǔn)確度的性能要求�����。
在精密度的性能評估中����,申請人對高、中?2 個(gè)濃度的?HBV-?RNA?精密度樣本進(jìn)行檢測�����,分別對批內(nèi)��、批間檢測結(jié)果進(jìn)行分析�����,結(jié)果表明精密度樣本的變異系數(shù)均不高于5%�,符合精密度的性能要求。
分析特異性研究包含交叉反應(yīng)和干擾研究���。交叉反應(yīng)的性能評估中���,申請人對人巨細(xì)胞病毒����、EB 病毒、人類免疫缺陷病毒�、丙型肝炎病毒、甲型肝炎病毒��、梅毒���、人類皰疹病毒 6 型、單純皰疹病毒 1 型�、單純皰疹病毒 2 型、甲型流感病毒、丙酸痤瘡桿菌�����、金黃色葡萄球菌�、白色念珠菌樣本進(jìn)行交叉反應(yīng)評價(jià)��。結(jié)果顯示�����,上述樣本與本產(chǎn)品均不產(chǎn)生交叉反應(yīng)�。
干擾研究實(shí)驗(yàn)中�����,申請人采用在中低濃度的 HBV-RNA 樣本中加入干擾物質(zhì)的方法進(jìn)行驗(yàn)證�����,拉米夫定(1.3μg/mL)�����、阿德福韋酯(21.24ng/mL)�、恩替卡韋(3.46μg/mL)、替比夫定(3.69μg/mL)�、普通 IFNα(2020pg/mL)、聚乙二醇干擾素α(10.88μg/L)���、總膽紅素(≤28mg/dL)���、甘油三酯(≤3000mg/dL)����、血紅蛋白(≤22g/dL)、總 IgG(≤ 40g/L)及不高于 2×107 IU/mL 的 HBV DNA 對本產(chǎn)品檢測結(jié)果均不產(chǎn)生干擾����。
本產(chǎn)品的陽性判斷值研究,采用乙肝感染者的血清樣本(B 型�����、C 型�����、D 型)及不同人的陰性血清樣本共 249 例�,使用本試劑盒進(jìn)行陽性判斷值研究,對檢測靶標(biāo) Ct 值進(jìn)行 ROC 分析�,確定其陽性判斷值為靶標(biāo) Ct≤26。通過對 HBV?DNA?陽性/陰性�����、HBsAg?陽性/陰性及?HBeAg?陽性/陰性樣本的靶標(biāo)進(jìn)行 Ct 值分析�����,HBV DNA 陽性/陰性、HBsAg 陽性/陰性及 HBeAg 陽性/陰性對靶標(biāo)陽性判斷值的判定無影響�����。
本產(chǎn)品預(yù)測 HBeAg 轉(zhuǎn)陰的陽性判斷值研究���,采用 79 例慢性HBV感染者(B 型�����、C 型����、D 型)隊(duì)列血清樣本(0?周���、48 ?周�、5年)��,使用本試劑盒進(jìn)行檢測����,對檢測結(jié)果分別計(jì) 算 B、C�����、D 型的 ROC 曲線和最佳預(yù)測 cutoff 值�,結(jié)果顯示?均不具有顯著差異�����;將 B 型���、C 型����、D 型樣本合并共同用于確定預(yù)測治療 5 年后 e 抗原轉(zhuǎn)陰的最佳 cutoff 值為 708copies/mL。此時(shí)的 PPV 為 81.8%��,NPV 為 87.0%����。
申請人對本產(chǎn)品的實(shí)時(shí)穩(wěn)定性���、開瓶及凍融次數(shù)限度穩(wěn)定性����、運(yùn)輸穩(wěn)定性進(jìn)行了研究�����,同時(shí)���,對樣本的穩(wěn)定性也進(jìn)行了研究�,確定了在各種條件下本產(chǎn)品及樣本的有效保存時(shí)間。
實(shí)時(shí)穩(wěn)定性:將三批次試劑的 A 盒置于 10~30℃���,B 盒?置于-20?± 5℃的條件下保存�����,連續(xù) 7 個(gè)月對試劑盒的外觀���、陰陽性符合率�����、檢出限、線性��、準(zhǔn)確度�����、精密度進(jìn)行考察�,各項(xiàng)性能指標(biāo)均符合要求,確定產(chǎn)品在規(guī)定的儲存條件下�����,可穩(wěn)定保存 6 個(gè)月��。
此外��,申請人對產(chǎn)品的開瓶及凍融次數(shù)限度穩(wěn)定性�����、運(yùn)輸穩(wěn)定性和樣本穩(wěn)定性分別進(jìn)行了研究��。結(jié)果顯示���,產(chǎn)品的性能均滿足產(chǎn)品說明書聲稱的要求。
申請人在首都醫(yī)科大學(xué)附屬北京佑安醫(yī)院�、蘭州大學(xué)第二醫(yī)院、沈陽市第六人民醫(yī)院共 3家機(jī)構(gòu)完成了臨床試驗(yàn)�,對考核試劑檢測人血清中 HBV-RNA 的臨床準(zhǔn)確性和臨床有效性進(jìn)行驗(yàn)證�����。
采用考核試劑與參比方法對臨床樣本進(jìn)行比較研究試驗(yàn)的方法驗(yàn)證本產(chǎn)品的臨床準(zhǔn)確性���。入組樣本為慢性 HBV 感染者��、其他肝臟疾病干擾樣本以及非肝臟疾病的正常人血清樣本���,共計(jì) 1033 例。參比方法選擇 ABI QuantStudio 3D芯片數(shù)字 PCR 系統(tǒng)��。
臨床準(zhǔn)確性研究在?3?家臨床單位共檢測了?1033?例血清樣本��,實(shí)際納入檢測?1033?例�,包括慢性?HBV?感染者樣本?709?例(68.64%)���,其他肝臟疾病干擾樣本?78?例(7.55%)�,非肝臟疾病的正常人樣本 246 例(23.81%)����;675 例有分型結(jié)果的樣本中,B 基因型 160?例�����、C 基因型 464 例��、D 基因型 51 例����。
對1033例入組血清樣本進(jìn)行考核試劑和參比方法符合率分析,陽性符合率? 99.26%(95%CI:98.11%~99.80%)����、陰性符合率98.99%(95%CI:97.65%~ 99.67%)、總體符合率 99.13%(95%CI:98.35%?~ 99.60%)�;Kappa(K)=0.983,考核試劑和參比方法具有較好的一致性���。
相關(guān)性分析顯示考核試劑和參比方法的線性相關(guān)系數(shù) r=0.9864 ,回歸分析得出的線性回歸方程為 y=0.9854x+0.1123�����,其中截距 a 的 95%的置信區(qū)間為[0.0255���,0.1992]�����,斜率 b 的95%的置信區(qū)間為[0.9693��,1.0015]。
對 675 例有基因分型數(shù)據(jù)的樣本檢測結(jié)果進(jìn)行分析��。B 基因型血清樣本�,考核試劑與參比方法定量檢測結(jié)果的相?關(guān)系數(shù) r=0.9873,線性回歸方程為 y =?0.9973x +?0.0083�����,截距 a 的 95%置信區(qū)間為[-0.1876�����,0.2042]����,斜率 b 的 95%置信區(qū)間為[0.9625�����,1.0321]�����;C 基因型血清樣本,考核試劑與參比方法定量檢測結(jié)果的相關(guān)系數(shù) r=0.9853�,線性回歸方程為 y =?0.9876x +?0.1229,截距 a 的 95%置信區(qū)間為[0.0161��,0.2296]�����,斜率 b 的 95%置信區(qū)間為[0.9672���,1.0080];D 基因型血清樣本���,考核試劑與參比方法定量檢測結(jié)果的相關(guān)系數(shù)r=0.9918��,線性回歸方程 為 y = 1.0241x -?0.1546����,截距 a 的 95%置信區(qū)間為[-?0.4375�����,0.1290]����,斜率 b 的 95%置信區(qū)間為[0.9748�,1.0732]。考核試劑與參比方法的定量檢測結(jié)果(lgcopies/mL)之差在±0.5 范圍內(nèi)����。
綜上所述,申請人考核試劑與參比方法檢測結(jié)果一致��。
本研究中分別對考核試劑定量檢測血清 HBV-RNA 用于預(yù)測?NAs?治療患者?HBeAg?轉(zhuǎn)陰��、HBV?DNA?低濃度的?CHB?患者中HBV-RNA 的檢出率進(jìn)行臨床有效性研究���。
1.考核試劑定量檢測血清?HBV-RNA 用于預(yù)測?NAs?抗病毒治療患者?HBeAg?轉(zhuǎn)陰研究
采用考核試劑對來源于回顧性隊(duì)列樣本的?78?個(gè)患者(接受 NAs 抗病毒治療的 HBeAg 陽性慢性 HBV 感染者)的共 624 例血清樣本進(jìn)行 HBV-RNA 定量檢測,每個(gè)患者采集 8 個(gè)標(biāo)本��,?分別對應(yīng)治療前和治療中的 8 個(gè)不同檢測點(diǎn):即 NAs 抗病毒?治療第?0?周��、24 周��、48 周��、1.5 年���、2 年��、3 年��、4 年�、5 年�����。?優(yōu)選治療第 48 周血清樣本中的 HBV DNA���、HBV-RNA 定量值用?于預(yù)測治療五年后(一個(gè)治療周期)HBeAg 轉(zhuǎn)陰的受試者工作特征曲線(ROC)分析和這些定量值對 HBeAg 轉(zhuǎn)陰的預(yù)測值分析。
分析結(jié)果顯示��,NAs 藥物治療的 78 例 HBeAg 陽性患者中����,治療 48 周 HBV DNA 定量和 HBV-RNA 定量預(yù)測 NAs 藥物治療五年后? HBeAg 轉(zhuǎn)陰的曲線下面積(AUC)依次為?0.736 和?0.874。
HBV DNA 以 156.0 IU/mL 為閾值獨(dú)立預(yù)測治療 5 年 HBeAg 轉(zhuǎn)陰的陽性預(yù)測值為 60.9%����,陰性預(yù)測值為 84.4%����;HBV-RNA 以 708 copies/mL 為閾值獨(dú)立預(yù)測治療 5 年 HBeAg 轉(zhuǎn)陰的陽性預(yù)測值為 80.6%�����,陰性預(yù)測值為 83.3%。HBV-RNA 在治療 48 周后預(yù)測五年 HBeAg 轉(zhuǎn)陰的預(yù)測價(jià)值優(yōu)于血清 HBV DNA 的預(yù)測價(jià)值��。
2.?HBV?DNA?低濃度?HBV?感染者中?HBV-RNA?檢出率研究
本次臨床試驗(yàn)共包含?374?例??HBV?DNA ?低濃度(<500IU/ml)或未檢出樣本��,其中 HBV DNA 陰性 227 例�����。在 HBV DNA 陰性樣本中�,HBV-RNA 檢出陽性 145 例,陽性檢出率為 63.88%(145/227)��;在 374 例 HBV DNA<500IU/mL 的慢性 HBV 感染者樣本中�����,HBV DNA 檢出陽性 147 例��,陽性檢出率 39.30%(147/374)���,HBV-RNA?檢出陽性? 249 ?例����,陽性檢出率66.58%(249/374)�����,χ2=54.26����,P<0.05���,具有顯著差異����。?可見在 HBV ?DNA 低濃度或未檢出的慢性 HBV 感染者中�����,HBV-RNA 具有較高的檢出率���。?
綜上所述���,臨床試驗(yàn)結(jié)果顯示本產(chǎn)品的臨床性能滿足技術(shù)審評要求。
四����、產(chǎn)品受益風(fēng)險(xiǎn)判定
本產(chǎn)品可用于對乙型肝炎病毒感染的輔助診斷,也可以 對 NAs 的治療效果作出預(yù)測��。我國乙型肝炎患者比較多�, NAs 治療可以提高乙型肝炎患者的治愈率�����,單獨(dú)檢測 HBV DNA 可能存在漏檢風(fēng)險(xiǎn)�����,研究表明����,通過對 HBV DNA 已經(jīng)?檢測不到的患者進(jìn)行 HBV-RNA 的檢測���,可以輔助對患者病情進(jìn)行監(jiān)測�。
該試劑盒已知和可預(yù)見的安全風(fēng)險(xiǎn)主要有以下幾個(gè)方面:
1. 與預(yù)期用途有關(guān)的安全風(fēng)險(xiǎn),例如本產(chǎn)品的檢測結(jié)果非患者病情評價(jià)的唯一指標(biāo)��,未結(jié)合患者臨床表現(xiàn)和其他實(shí)驗(yàn)室檢測對病情進(jìn)行綜合分析�。
2. 與生產(chǎn)有關(guān)的安全風(fēng)險(xiǎn),例如使用未經(jīng)過驗(yàn)證或檢驗(yàn)不合格的原材料�。
3. 與運(yùn)輸與儲存有關(guān)的安全風(fēng)險(xiǎn)����,例如試劑的運(yùn)輸和儲存超出規(guī)定條件。
4. 與使用有關(guān)的安全風(fēng)險(xiǎn)���,例如使用儀器和試劑時(shí)沒有按照說明書要求進(jìn)行操作�。
5. ?生物危險(xiǎn)��,例如直接丟棄使用后或失效的產(chǎn)品或產(chǎn)品使用過程中產(chǎn)生的廢棄物未按照醫(yī)療廢棄物統(tǒng)一銷毀處理�。
通過對乙型肝炎病毒 RNA(HBV-RNA)測定試劑盒(PCR-?熒光探針法)從生產(chǎn)原材料�����、配制、檢測����、包裝、運(yùn)輸�����、儲存�����、使用方法及安全注意事項(xiàng)���、保存和用后處理等全過程危害判定�����、風(fēng)險(xiǎn)估計(jì)�、預(yù)防化解,從產(chǎn)品技術(shù)要求和使用說明書及企業(yè)規(guī)章制度對產(chǎn)品質(zhì)量的全過程控制和風(fēng)險(xiǎn)防范措施���,已將產(chǎn)品的安全風(fēng)險(xiǎn)系數(shù)降到了驗(yàn)收準(zhǔn)則規(guī)定的可接受范圍內(nèi)�,同時(shí)采取降低風(fēng)險(xiǎn)的措施后沒有引入新的風(fēng)險(xiǎn)。在目前認(rèn)知水平上�,認(rèn)為該產(chǎn)品上市帶來的受益大于風(fēng)險(xiǎn)。盡管目前認(rèn)為該試劑盒的受益大于風(fēng)險(xiǎn)�,但是為保證用械安全,基于對主要剩余風(fēng)險(xiǎn)的防控��,已在該試劑盒說明書中提示以下信息:
本試劑盒用于體外定量測定人血清樣本中的乙型肝炎病毒 RNA(HBV-RNA)�����。
已有研究數(shù)據(jù)顯示�,外周血血清中 HBV-RNA 可反映肝內(nèi) HBV 病毒的轉(zhuǎn)錄活性��,在部分血清中 HBV DNA 低于檢測下限?的樣本中��,HBV-RNA 仍可以被檢測到�����。同時(shí)�,在 NAs 治療中�,?血清 HBV-RNA 可輔助作為 HBeAg 轉(zhuǎn)陰的預(yù)測的指標(biāo)之一,血 清 HBV-RNA 結(jié)果為陰性��,需要結(jié)合其他指標(biāo)共同用于指導(dǎo) NAs 的治療。該檢測結(jié)果不得作為患者病情評價(jià)的唯一指標(biāo)�,必須結(jié)合患者臨床表現(xiàn)和其他實(shí)驗(yàn)室檢測對病情進(jìn)行綜合分析。本試劑盒不得用于 HBV 的血液篩查�����。
該試劑盒說明書中明確了該試劑盒檢驗(yàn)方法的局限性及注意事項(xiàng)��。
綜合評價(jià)意見
本申報(bào)項(xiàng)目為境內(nèi)第三類醫(yī)療器械產(chǎn)品注冊�。申請人的注冊申報(bào)資料符合現(xiàn)行要求�,依據(jù)《醫(yī)療器械監(jiān)督管理?xiàng)l例》(國務(wù)院令第?680?號)、《體外診斷試劑注冊管理辦法》(原國家食品藥品監(jiān)督管理總局令第 5 號)等相關(guān)醫(yī)療器械法規(guī)?與配套規(guī)章����,經(jīng)系統(tǒng)評價(jià)后,建議準(zhǔn)予注冊���。
2022?年?11?月?10?日